चार्ल्स का नियम
इस नियम के अनुसार, नियत पर किसी गैस के निश्चित द्रव्यमान का आयतन गैस के परमताप के अनुक्रमानुपाती होता है।
अर्थात् V ∝ T
अथवा V/T = नियतांक
अतः इस समीकरण द्वारा स्पष्ट होता है कि यदि हम गैस के दाब को नियत रखते हुए गैस के ताप को दोगुना कर दें तो गैस का आयतन भी दोगुना हो जायेगा।
चार्ल्स के नियम का सूत्र
माना नियत दाब पर किसी द्रव्यमान की गैस का प्रारंभिक ताप व आयतन T1 व V1 हों तथा गैस के अंतिम ताप व आयतन T2 व V2 हों तो चार्ल्स के नियम से
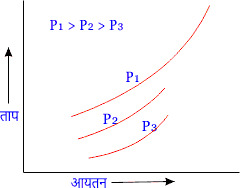
\( { \frac{V_1}{T_1} = \frac{V_2}{T_2} } \)चित्र में किसी गैस के विभिन्न दाबों P1 , P2 व P3 पर ताप व आयतन के बीच ग्राफ को प्रदर्शित किया गया है।
आदर्श गैस दाब की सभी अवस्थाओं में चार्ल्स के नियम का पालन करती है।
अणुगति सिद्धांत के आधार पर चार्ल्स का नियम
अणुगति सिद्धांत से निश्चित द्रव्यमान की गैस का दाब
P = \( \large \frac{1}{2} (\frac{m}{V}) \) v2
जहां V – गैस का आयतन, m – गैस के प्रत्येक कण का द्रव्यमान , n – गैस के अणुओं की संख्या तथा v – अणुओं का वर्ग माध्य मूल चाल है।
अतः PV = \( \large \frac{1}{3} \) mn v2
V = \( \large \frac{2}{3} \frac{n}{P} × \frac{1}{2} \) mn v2 (2 से गुणा-भाग)
चूंकि गैस के एक अणु की गतिज ऊर्जा = \( \large \frac{1}{2} \)mv2
= \( \large \frac{2}{3} \) kT होता है। तब
V = \( \large \frac{2}{3} \frac{n}{P} × \frac{3}{2} \) kT
V = \( \large \frac{nkT}{P} \)
यदि गैस का दाब नियत हो तब एक निश्चित द्रव्यमान की गैस के लिए n भी नियत होगा। एवं k तो नियतांक ही है तब
V ∝ T
यही चार्ल्स का नियम है।
Leave a Reply