बॉयल का नियम, ग्राफीय निरूपण
इस नियम के अनुसार, नियत ताप पर किसी गैस के निश्चित द्रव्यमान का आयतन उस गैस के दाब के व्युत्क्रमानुपाती होता है।
अर्थात् V ∝ \( \large \frac{1}{P} \)
अथवा VP = नियतांक
अर्थात् इस समीकरण द्वारा स्पष्ट होता है कि यदि हम गैस के ताप को नियत रखते हुए उसके दाब को दोगुना कर दें तो गैस का आयतन आधा रह जाएगा। या इसके विपरीत आयतन को दोगुना कर दिया जाए, तो गैस का दाब आधा हो जाएगा।
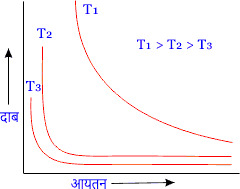
बॉयल के नियम का ग्राफीय निरूपण
माना नियत ताप पर किसी द्रव्यमान की गैस का प्रारंभिक दाब व आयतन P1 व V1 हो तथा गैस के अंतिम दाब व आयतन P2 व V2 हो तो बॉयल के नियम से
चित्र में किसी गैस के लिए विभिन्न नियत तापों T1 , T2 , T3 पर दाब व आयतन के बीच ग्राफ को दर्शाया गया है।
अतः ताप और दाब की सभी अवस्थाओं पर जैसे बॉयल के नियम का पालन नहीं करती है। अर्थात् गैसें केवल निम्न दाब तथा ऊंचे ताप पर ही बॉयल के नियम (boyle’s law) का पालन करती हैं।
आदर्श गैस बॉयल के नियम का पालन करती है वास्तव में यह एक काल्पनिक गैस है।
अणुगति सिद्धांत के आधार पर बॉयल का नियम
किसी निश्चित द्रव्यमान की गैस द्वारा आरोपित दाब
P = \( \large \frac{1}{3} \)mnv2
सूत्र में mn गैस का द्रव्यमान है जो कि निश्चित है। यदि ताप नियत रहे तो v2 भी नियत रहेगा तब
PV = नियतांक
यही बॉयल का नियम है।

Leave a Reply