संकरण, यह कितने प्रकार का होता है, उदाहरण
संकरण
किसी परमाणु के लगभग समान ऊर्जा वाले कक्षक जब परस्पर मिलकर समान ऊर्जा तथा आकार के नए कक्षक बनाते हैं। तो इस प्रक्रम को संकरण (hybridization) कहते हैं। तथा बनने वाले नए कक्षक को संकरित कक्षक कहते हैं।
उदाहरण – कार्बन परमाणु का एक 2s कक्षक तथा तीन 2p कक्षक संकरित होकर उचित ऊर्जा के चार नए sp3 संकर कक्षक बनाते हैं।
संकरण के लक्षण
संकरण में बनने वाले नए कक्षक सदैव समान ऊर्जा तथा आकार के होते हैं।
संकरण प्रक्रम में भाग लेने वाले कक्षको की संख्या, संकरण में बनने वाले नए कक्षको की संख्या के बराबर होती है।
संकर कक्षक की स्थायी आबंध बनाने में शुद्ध कक्षक की तुलना में अधिक सक्षम होते हैं।
संकरण के प्रकार
s, p तथा d कक्षको के संकरण निम्न प्रकार के होते हैं।
1. sp संकरण
2. sp2 संकरण
3. sp3 संकरण
4. sp3d संकरण
5. sp3d2 संकरण
1. sp संकरण
जब एक s-कक्षक तथा एक p-कक्षक परस्पर संकरित होकर समान ऊर्जा के दो नए कक्षक बनाते हैं तो इस प्रकार के संकरण को sp संकरण कहते हैं।
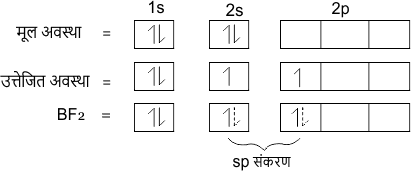
उदाहरण – BeF2 में केंद्रीय परमाणु का इलेक्ट्रॉनिक विन्यास
Be = 4 = 1s2 2s2
sp संकरण के अन्य उदाहरण C2H2, BeCl2, HgCl2 तथा CO2 हैं।
sp संकरण कक्षको की आकृति रेखीय होती है तथा इनके परमाणुओं के बीच बंध कोण 180° होता है। प्रत्येक sp संकरण अक्षीय अतिव्यापन द्वारा दो सिग्मा बंध बनाते हैं।
2. sp2 संकरण
जब एक s-कक्षक तथा दो p-कक्षक परस्पर संकरित होकर समान ऊर्जा के तीन नए कक्षक बनाते हैं तो इस प्रकार के संकरण को sp2 संकरण कहते हैं।
उदाहरण – BCl3 में केंद्रीय परमाणु का इलेक्ट्रॉनिक विन्यास
B = 5 = 1s2 2s2 2p1
संकरण के अन्य उदाहरण BF3, SO2, NO3– आदि हैं।
sp2 संकरण कक्षको की आकृति त्रिभुजाकार (त्रिकोणीय समतली) होती है। तथा इनके परमाणुओं के बीच बंध कोण 120° होता है।
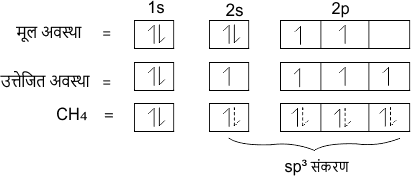
3. sp3 संकरण
जब एक s-कक्षक तथा तीन p-कक्षक परस्पर संकरित होकर समान ऊर्जा के चार नए कक्षक बनाते हैं तो इस प्रकार के संकरण को sp3 संकरण कहते हैं।
उदाहरण – मेथेन CH4 में केंद्रीय परमाणु का इलेक्ट्रॉनिक विन्यास
C = 6 = 1s2 2s2 2p2
संकरण के अन्य उदाहरण CCl4, H2O, SiF4, NH3 आदि हैं।
sp3 संकरण कक्षको की आकृति चतुष्फलकीय होती है। तथा इनके परमाणुओं के बीच बंध कोण 109° 28′ होता है। कहीं-कहीं इस बंध कोण को 109° 5′ भी लिख दिया जाता है।
d-कक्षको वाले तत्वों में संकरण
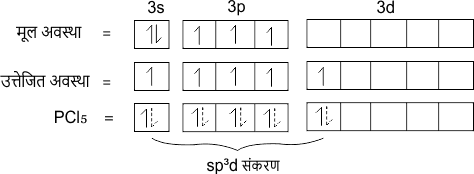
4. sp3d संकरण
जब एक s-कक्षक तथा तीन p-कक्षक एवं एक d-कक्षक परस्पर संकरित होकर समान ऊर्जा के पांच नए कक्षक बनाते हैं तो इस प्रकार के संकरण को sp3d संकरण कहते हैं।
उदाहरण – PCl5 में केंद्रीय परमाणु का इलेक्ट्रॉनिक विन्यास
P = 15 = 1s2 2s2 2p6 3s2 3p3 3d0
sp3d संकरण के अन्य उदाहरण PF5 आदि हैं।
sp3d संकरण कक्षको की आकृति त्रिकोणीय द्विपिरामिडी होती है। तथा इनके परमाणुओं के बीच बंध कोण 120° व 90° होता है।
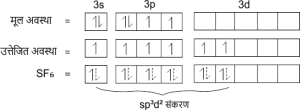
5. sp3d2 संकरण
जब एक s-कक्षक तथा तीन p-कक्षक एवं दो d-कक्षक परस्पर संकरित होकर समान ऊर्जा के छह नए कक्षक बनाते हैं तो इस प्रकार के संकरण को sp3d2 संकरण कहते हैं।
उदाहरण – SF6 में केंद्रीय परमाणु का इलेक्ट्रॉनिक विन्यास
S = 16 = 1s2 2s2 2p6 3s2 3p4 3d0
sp3d2 संकरण कक्षको की आकृति अष्टफलकीय होती है। तथा इनके परमाणुओं के बीच बंध कोण 90° होता है।

Hello