सहसंयोजक आबंध, प्रकार, यौगिक का उदाहरण, सह संयोजी बंध
सहसंयोजक आबंध
परमाणुओं के मध्य इलेक्ट्रॉन युग्मों की परस्पर साझेदारी द्वारा जो बंध का निर्माण होता है उसे सहसंयोजक आबंध (covalent bond) कहते हैं। सहसंयोजक बंद को उदाहरण द्वारा समझा जा सकता है।
सहसंयोजक बंध के उदाहरण
1. क्लोरीन अणु Cl2 का बनना –
क्लोरीन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p6 3s2 3p5 है। अर्थात् क्लोरीन परमाणु के बाह्य कोश में 7 इलेक्ट्रॉन हैं। इससे स्पष्ट होता है कि क्लोरीन को अक्रिय गैस की स्थायी संरचना प्राप्त करने के लिए एक इलेक्ट्रॉन की कमी है। जब दो क्लोरीन परमाणु परस्पर संयोग करते हैं। तथा उनके मध्य एक साझे का इलेक्ट्रॉन युग्म बन जाता है। यह साझे का इलेक्ट्रॉन युग्म दोनों परमाणुओं के बाह्य कोश में रहता है। इस प्रकार दोनों क्लोरीन परमाणु के बाह्य कोश में 8 इलेक्ट्रॉन हो जाते हैं। अर्थात् यह अक्रिय गैस की स्थायी संरचना प्राप्त कर लेते हैं। इस प्रकार दो क्लोरीन परमाणुओं के मध्य सहसंयोजी आबंध बनते हैं।
Note – • डॉट द्वारा बाह्य कोश में इलेक्ट्रॉन को दर्शाया गया है।
2. हाइड्रोजन क्लोराइड अणु HCl का बनना –
हाइड्रोजन परमाणु के बाह्य कोश में एक इलेक्ट्रॉन होता है। एवं क्लोरीन परमाणु के बाह्य कोश में 7 इलेक्ट्रॉन होते हैं। इन दोनों को अक्रिय गैस की स्थायी संरचना प्राप्त करने के लिए एक इलेक्ट्रॉन युग्म की आवश्यकता होती है। जब हाइड्रोजन तथा क्लोरीन के एक-एक अणु संयोग करते हैं। तो इनके मध्य साझे का एक इलेक्ट्रॉन युग्म बन जाता है। जो दोनों परमाणुओं के बाह्य कोश में रहता है। इस प्रकार हाइड्रोजन परमाणु के बाह्य कोश में दो इलेक्ट्रॉन तथा क्लोरीन परमाणु के बाह्य कोश में 8 इलेक्ट्रॉन हो जाते हैं। अर्थात् दोनों परमाणु अक्रिय गैस की स्थायी संरचना प्राप्त कर लेते हैं। चित्र द्वारा अच्छे से समझें।
Note – ऊपर दोनों उदाहरणों में एक एक इलेक्ट्रॉन युग्मों का साझा किया गया है। जब दो परमाणुओं में परस्पर दो इलेक्ट्रॉन युग्मों का साझा होता है तो उसे द्वि-आबंध (double bond) कहते हैं।
तथा जब दो परमाणुओं के मध्य एक से अधिक इलेक्ट्रॉन युग्मों का साझा होता है तो उसे बहु-आबंध (multiple bond in Hindi) कहते हैं।
उदाहरण –
1. CO2 अणु का बनना –
C = 6 = 1s2 2s2 2p2 बाह्य कोश में इलेक्ट्रॉन = 4
O = 8 = 1s2 2s2 2p4 बाह्य कोश में इलेक्ट्रॉन = 6
2. नाइट्रोजन अणु N2 का बनना –
N = 7 = 1s2 2s2 2p3 बाह्य कोश में इलेक्ट्रॉन = 5
अतः नाइट्रोजन के दोनों परमाणु तीन-तीन इलेक्ट्रॉनों का साझा करके अक्रिय गैस की स्थायी संरचना प्राप्त करते हैं। यह बहु-आबंध का एक उदाहरण है।
Note – बाह्य कोश में इलेक्ट्रॉनों की संख्या किस प्रकार निकाली जा रही है। तो समझें।
ऑक्सीजन का परमाणु क्रमांक 8 है।
ऑक्सीजन = 1s2 2s2 2p4
अर्थात आखिरी वाली में जितनी घातें होती है वह बाह्य कोश में इलेक्ट्रॉनों की संख्या है।
जैसे यहां 2s2 2p4 अर्थात 6 बाह्य कोश में इलेक्ट्रॉन है। आखिर कब मतलब 1, 2, 3, 4,….. में जो आखिरी आएगा चाहे उसमें कितने भी s, p हों।
जैसे– 1s2 2s2 2p6 3s1
इसके बाह्य कोश में इलेक्ट्रॉन एक है। क्योंकि आख़िर में 3s1 है।
सहसंयोजक यौगिक के लक्षण
1. सहसंयोजक यौगिक अणुओं से बनी होती हैं।
2. यह यौगिक दुर्बल अंतराण्विक बलों द्वारा जुड़े होते हैं। जिस कारण इनके गलनांक और क्वथनांक कम होते हैं।
3. यह यौगिक जल में अविलेय होते है परंतु ध्रुवीय विलायकों जैसे बेंजीन में विलेय होते हैं।
4. यह यौगिक सामान्य ताप और दाब पर द्रव या गैस होते हैं परंतु उच्च अणुभार वाले यौगिक ठोस होते हैं।


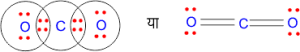
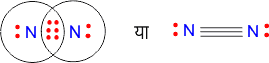
Leave a Reply