ऐल्कोहॉल, फीनॉल एवं ईथर
प्रश्न 1: अल्कोहल की तैयारी के विभिन्न तरीकों का वर्णन करें। उदाहरण सहित समझाएं।
उत्तर: अल्कोहल की तैयारी के लिए निम्नलिखित प्रमुख विधियाँ प्रयोग की जाती हैं:
- एल्कीन से हाइड्रेशन द्वारा: एल्कीन को पानी के साथ एसिड उत्प्रेरक की उपस्थिति में प्रतिक्रिया कराकर अल्कोहल प्राप्त किया जा सकता है। असममित एल्कीन के मामले में, हाइड्रेशन प्रतिक्रिया मार्कोनिकोव के नियम के अनुसार होती है।
उदाहरण: प्रोपीन + \(H_2O (H_2SO_4)→\) प्रोपेन-2-ओल
- कार्बोनिल यौगिकों के अपचयन द्वारा: अल्डिहाइड और कीटोन को हाइड्रोजन गैस की उपस्थिति में उत्प्रेरक के साथ क्रियान्वित कराकर अल्कोहल में परिवर्तित किया जा सकता है।
उदाहरण: एथेनाल + \(H_2 (Pd) →\) एथेनोल
- गृनार्ड अभिकर्मकों का प्रयोग: गृनार्ड अभिकर्मकों को अल्डिहाइड या कीटोन के साथ क्रियान्वित कराके अल्कोहल प्राप्त किया जा सकता है।
उदाहरण: एथिल मैग्नीशियम ब्रोमाइड + एथेनल → प्रोपेन-2-ओल
प्रश्न 2: फिनॉल की तैयारी के विभिन्न तरीकों की चर्चा करें।
उत्तर: फिनॉल को निम्नलिखित विधियों द्वारा तैयार किया जा सकता है:
- हैलोएरेन से: क्लोरोबेंजीन को सोडियम हाइड्रॉक्साइड के साथ उच्च तापमान और दाब पर प्रतिक्रिया कराकर सोडियम फिनॉक्साइड बनता है, जिसे एसिड के साथ उपचारित कर फिनॉल प्राप्त किया जा सकता है।
उदाहरण: \(C_6H_5Cl + NaOH (623K,320 atm) → C_6H_5ONa + HClHCl + H_2O → C_6\)
- बेंजीनसल्फोनिक एसिड से: बेंजीन को सल्फ्यूरिक एसिड के साथ प्रतिक्रिया कर बेंजीनसल्फोनिक एसिड बनाया जाता है, जिसे सोडियम हाइड्रॉक्साइड के साथ उच्च तापमान पर गरम करके सोडियम फिनॉक्साइड बनाया जाता है, जिसे एसिड के साथ उपचारित कर फिनॉल प्राप्त किया जा सकता है।
उदाहरण: \(C_6H_5SO_3H + NaOH → C_6H_5ONa + H_2 OHCl + H_2O → C_6H_5OH\)
- डायज़ोनियम लवण से: एरॉमेटिक प्राथमिक अमीन को नाइट्रस एसिड के साथ प्रतिक्रिया कराकर डायज़ोनियम लवण प्राप्त किया जाता है, जिसे जल या कमजोर एसिड के साथ गर्म करके फिनॉल में परिवर्तित किया जा सकता है।
उदाहरण: \(C_6H_5N^+_2Cl^- + H_2O → C_6H_5OH + N_2 + HCl\)
प्रश्न 3: फिनॉल की अम्लीयता का वर्णन करें। इसे एथेनॉल से तुलना करें।
उत्तर:
फिनॉल की अम्लीयता उसकी संरचना के कारण होती है। फिनॉल में हाइड्रॉक्सिल समूह सीधे बेंजीन रिंग से जुड़ा होता है, जो इलेक्ट्रॉनों को आकर्षित करता है और ओ-एच बंध की ध्रुवीयता को बढ़ाता है। इसके परिणामस्वरूप, फिनॉक्साइड आयन की स्थिरता बढ़ जाती है।
एथेनॉल की तुलना में, फिनॉल अधिक अम्लीय होता है क्योंकि फिनॉक्साइड आयन की स्थिरता में योगदान देने वाले प्रतिध्वनि संरचनाओं के कारण यह आयन अधिक स्थिर होता है। जबकि एथेनॉल में अल्कोक्साइड आयन की नकारात्मक आवेश केवल ऑक्सीजन पर केन्द्रित होती है, फिनॉक्साइड आयन में यह आवेश प्रतिध्वनि के माध्यम से बेंजीन रिंग में फैल जाता है।
प्रश्न 4: विलियमसन ईथर संश्लेषण की प्रक्रिया को समझाएं और इसके प्रयोग की सीमाओं का वर्णन करें।
उत्तर:
विलियमसन ईथर संश्लेषण एक महत्वपूर्ण विधि है जिसका उपयोग सरल और मिश्रित ईथरों की तैयारी के लिए किया जाता है। इस प्रक्रिया में एक अल्काइल हैलाइड को सोडियम अल्कॉक्साइड के साथ क्रियान्वित कराके ईथर प्राप्त किया जाता है।
प्रतिक्रिया:
R − X + NaOR′ → R − O − R′ + NaX
यह विधि केवल प्राथमिक अल्काइल हैलाइड के लिए उपयुक्त है क्योंकि द्वितीयक और तृतीयक अल्काइल हैलाइड के साथ प्रतिस्थापन की बजाय उन्मूलन प्रतिक्रिया होती है, जिससे अपेक्षित ईथर की प्राप्ति नहीं होती।
सीमाएँ:
- द्वितीयक और तृतीयक अल्काइल हैलाइड के साथ प्रतिक्रिया के दौरान, प्रतिस्थापन प्रतिक्रिया की बजाय उन्मूलन प्रतिक्रिया की प्रवृत्ति अधिक होती है, जिससे अल्कीन का निर्माण होता है, न कि ईथर का।
प्रश्न 5: अल्कोहल, फिनॉल, और ईथर के भौतिक गुणों की तुलना करें और समझाएँ कि उनकी संरचना से ये गुण कैसे प्रभावित होते हैं।
उत्तर:
अल्कोहल के भौतिक गुण:
- उबलांक (Boiling Point): अल्कोहल का उबलांक उच्च होता है क्योंकि इसमें intermolecular hydrogen bonding होती है। जैसे-जैसे कार्बन की संख्या बढ़ती है, उबलांक भी बढ़ता है। शाखित संरचनाओं के साथ उबलांक कम हो जाता है क्योंकि Van der Waals बलों की कमी होती है।
- घुलनशीलता (Solubility): अल्कोहल पानी में घुलनशील होते हैं क्योंकि OH समूह पानी के साथ hydrogen bonding बना सकता है। जैसे-जैसे अल्काइल समूह बड़ा होता है, घुलनशीलता कम हो जाती है।
फिनॉल के भौतिक गुण:
- उबलांक: फिनॉल का उबलांक भी उच्च होता है, और यह अल्कोहल से अधिक होता है क्योंकि इसमें intermolecular hydrogen bonding और resonance दोनों होते हैं।
- घुलनशीलता: फिनॉल पानी में अच्छी तरह से घुलता है, लेकिन इसका घुलनशीलता अल्कोहल की तुलना में कम होती है क्योंकि फिनॉक्साइड आयन की resonance स्थिरता और बेंजीन रिंग के हाइड्रोफोबिक प्रभाव के कारण।
ईथर के भौतिक गुण:
- उबलांक: ईथर का उबलांक अपेक्षाकृत कम होता है क्योंकि इनमें intermolecular hydrogen bonding नहीं होती, केवल dipole-dipole interaction होते हैं। इसका उबलांक समान आणविक द्रव्यमान वाले अल्कोहल से काफी कम होता है।
- घुलनशीलता: ईथर की घुलनशीलता अल्कोहल और फिनॉल की तुलना में कम होती है, लेकिन समान द्रव्यमान वाले हाइड्रोकार्बन की तुलना में अधिक होती है क्योंकि ईथर में ऑक्सीजन पानी के साथ hydrogen bonding बना सकता है।
प्रश्न 6: फिनॉल के रासायनिक गुणों का वर्णन करें और इसकी प्रतिक्रियाओं के उदाहरण दें।
उत्तर:
फिनॉल के रासायनिक गुण:
- एसिडिटी (Acidity):
फिनॉल में OH समूह बेंजीन रिंग से जुड़ा होता है, जिससे यह एसिडिक होता है। यह सक्रिय धातुओं जैसे कि सोडियम के साथ प्रतिक्रिया करता है और सोडियम फिनॉक्साइड बनाता है।
\(C_6H_5OH + Na → C_6H_5ONa + H_2\)
- इलेक्ट्रोफिलिक एरोमेटिक प्रतिस्थापन (Electrophilic Aromatic Substitution):
OH समूह फिनॉल को इलेक्ट्रोफिलिक प्रतिस्थापन के प्रति संवेदनशील बनाता है, विशेषकर ओरथो और पारा स्थितियों पर। उदाहरण के लिए:
नाइट्रेशन: फिनॉल को पतला नाइट्रिक एसिड के साथ प्रतिक्रिया करने पर 2-नाइट्रोफिनॉल और 4-नाइट्रोफिनॉल प्राप्त होते हैं।
\(C_6H_5OH + HNO_3 → C_6H_4(NO_2)OH + H_2O\)
हैलोजीनेशन: ब्रोमिनेशन में फिनॉल को ब्रोमिन जल के साथ प्रतिक्रिया करने पर 2,4,6-ट्रिब्रोम फिनॉल प्राप्त होता है।
\(C_6H_5OH + Br_2 → C_6H_2Br_3OH + HBr\)
कोल्बे प्रतिक्रिया (Kolbe’s Reaction): फिनॉक्साइड आयन को CO2 के साथ प्रतिक्रिया करने पर मुख्य उत्पाद के रूप में ओर्थो-हाइड्रॉक्सीबेंजोइक एसिड (सैलिसिलिक एसिड) प्राप्त होता है।
\(C_6H_5ONa + CO_2 + H_2O → C_6H_4(OH)COOH\)
प्रश्न 7: विलियमसन ईथर संश्लेषण क्या है? इसका सिद्धांत और प्रक्रिया विस्तार से बताइए।
उत्तर:
विलियमसन ईथर संश्लेषण (Williamson Ether Synthesis):
विलियमसन ईथर संश्लेषण एक महत्वपूर्ण विधि है जिसका उपयोग सरल और मिश्रित ईथर तैयार करने के लिए किया जाता है। इसमें एक अल्कॉक्साइड आयन को एक अल्काइल हैलाइड के साथ प्रतिक्रिया कराकर ईथर बनाया जाता है।
सिद्धांत: यह एक \(SN^2\) प्रतिक्रिया है, जिसमें एक न्यूक्लियोफिलिक अल्कॉक्साइड आयन (\(RO^-\)) एक इलेक्ट्रोफिलिक अल्काइल हैलाइड (R-X) पर हमला करता है, जिससे C-O बंध का निर्माण होता है और \(X^-\) छोड़ दिया जाता है।
प्रक्रिया:
\(R-O^- + R’ – X → R-O-R’ + X^-\)यह प्रतिक्रिया सामान्यतः प्राथमिक अल्काइल हैलाइड्स के साथ अच्छी तरह से काम करती है। द्वितीयक या तृतीयक अल्काइल हैलाइड्स के साथ, एलिमिनेशन प्रतिक्रिया अधिक होती है, जिससे अपेक्षित ईथर नहीं प्राप्त हो पाता।
सीमाएँ:
- द्वितीयक और तृतीयक अल्काइल हैलाइड्स के साथ विलियमसन ईथर संश्लेषण में प्रतिस्थापन की बजाय उन्मूलन प्रतिक्रिया होने की संभावना अधिक होती है।
प्रश्न 8: अल्कोहल की रासायनिक प्रतिक्रियाओं का वर्णन करें। विशेष रूप से, ऑक्सीकरण और निर्जलीकरण प्रतिक्रियाओं का वर्णन करें।
उत्तर:
अल्कोहल की रासायनिक प्रतिक्रियाएँ:
ऑक्सीकरण (Oxidation): अल्कोहल का ऑक्सीकरण करके अल्डिहाइड, कीटोन या कार्बोक्सिलिक एसिड बनाया जा सकता है। प्राथमिक अल्कोहल का ऑक्सीकरण करके अल्डिहाइड और फिर कार्बोक्सिलिक एसिड प्राप्त होता है, जबकि द्वितीयक अल्कोहल का ऑक्सीकरण कीटोन में होता है। तृतीयक अल्कोहल का ऑक्सीकरण नहीं होता।
निर्जलीकरण (Dehydration): अल्कोहल का निर्जलीकरण करने पर अल्कीन प्राप्त होता है। इसके लिए सामान्यतः सल्फ्यूरिक एसिड (H2SO4) का उपयोग किया जाता है।
तृतीयक अल्कोहल का निर्जलीकरण सबसे आसान होता है, इसके बाद द्वितीयक और फिर प्राथमिक अल्कोहल का निर्जलीकरण होता है।
प्रश्न 9 : अल्कोहल की अम्लीयता की चर्चा करें। इसे पानी और फिनॉल की अम्लीयता से तुलना करें।
उत्तर:
अल्कोहल की अम्लीयता O-H बंध की ध्रुवीयता पर निर्भर करती है। जब अल्कोहल का \(H^+\) आयन निकलता है, तो एक अल्कोक्साइड आयन बनता है, जो एक कमजोर अम्ल के रूप में कार्य करता है। इस संदर्भ में, हम पानी और फिनॉल के साथ इसकी तुलना कर सकते हैं:
अल्कोहल की अम्लीयता:
अल्कोहल एक कमजोर अम्ल है, और इसका pKa मान उच्च होता है, जो इसे कम अम्लीय बनाता है। उदाहरण के लिए, एथेनॉल का pKa लगभग 15.9 है।
इलेक्ट्रोन दाता समूह (जैसे -CH3) O-H बंध की ध्रुवीयता को कम कर देते हैं, जिससे अम्लीयता और भी घट जाती है।
पानी की अम्लीयता:
पानी का pKa मान लगभग 15.7 है, जो अल्कोहल से थोड़ा अधिक अम्लीय बनाता है। इस कारण से, पानी एक बेहतर प्रोटॉन दाता होता है।
फिनॉल की अम्लीयता:
फिनॉल का pKa मान लगभग 10 है, जो इसे अल्कोहल और पानी दोनों से अधिक अम्लीय बनाता है। इसका कारण फिनॉक्साइड आयन की प्रतिध्वनि स्थिरता है, जिससे फिनॉल के O-H बंध की ध्रुवीयता बढ़ जाती है।
प्रश्न 10: ईथर के विलयन गुण (Solubility) और अन्य भौतिक गुणों की चर्चा करें। ईथर की पानी में घुलनशीलता की तुलना अल्कोहल से करें।
उत्तर:
ईथर के भौतिक गुण:
उबलांक (Boiling Point):
ईथर का उबलांक अपेक्षाकृत कम होता है क्योंकि इनमें intermolecular hydrogen bonding नहीं होती। इसके बजाय, इनके बीच dipole-dipole interactions होते हैं। ईथर का उबलांक समान आणविक द्रव्यमान वाले अल्कोहल की तुलना में काफी कम होता है।
घुलनशीलता (Solubility):
ईथर की पानी में घुलनशीलता अल्कोहल की तुलना में कम होती है। अल्कोहल में OH समूह होता है, जो पानी के साथ hydrogen bonding बनाकर अच्छी तरह घुलता है। जबकि, ईथर में R-O-R’ समूह होता है, जिसमें ऑक्सीजन और कार्बन के बीच dipole-dipole interaction होते हैं, जो पानी के साथ सीमित hydrogen bonding करता है।
उदाहरण:
\(CH_3OCH_3\) (Dimethyl Ether) की घुलनशीलता 7.5g/100 ml (water)
जबकि:
\(CH_3OH\) (Methanol) की घुलनशीलता असीमित (Unlimited)
यह दर्शाता है कि समान आणविक द्रव्यमान होने पर भी, अल्कोहल की पानी में घुलनशीलता ईथर की तुलना में काफी अधिक होती है।
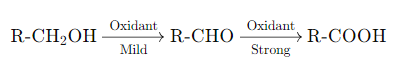
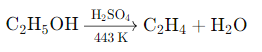
Leave a Reply