ऑफबाऊ का नियम, सिद्धांत का उल्लेख कीजिए, इलेक्ट्रॉनिक विन्यास
ऑफबाऊ का नियम
ऑफबाऊ नियम के अनुसार, किसी परमाणु में इलेक्ट्रॉनों का प्रवेश विभिन्न उपकोशों में उनकी ऊर्जा के बढ़ते हुए क्रमानुसार होता है। अर्थात् इलेक्ट्रॉन कम ऊर्जा वाले उपकोश में सर्वप्रथम भरते हैं। इसके बाद इलेक्ट्रॉन अधिक ऊर्जा वाले उपकोश में प्रवेश करते हैं। ऑफबाऊ जर्मन भाषा का एक शब्द है जिसका अर्थ है। रचना या निर्माण करना।
आसान शब्दों में कहें, तो इलेक्ट्रॉन सबसे पहले कम उर्जा वाली कक्षको में जाते हैं। इसके भरने के बाद उच्च ऊर्जा वाली कक्षको को में भरते हैं।
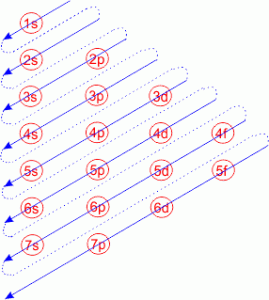
इलेक्ट्रॉनों के कक्षको में भरने के क्रम को आसानी से प्रस्तुत चित्र द्वारा समझा जा सकता है।
अतः इस नियम के अनुसार उपकोशों में इलेक्ट्रॉनों के भरने का क्रम निम्नलिखित प्रकार से होता है।
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
यह सब चित्र द्वारा ही किया गया है चित्र द्वारा आसानी से इलेक्ट्रॉनों का कक्षको में भरना समझाया जा सकता है। उपरोक्त क्रम से स्पष्ट होता है कि सभी उपकोशों में सबसे पहले इलेक्ट्रॉन 1s उपकोश में भरते हैं। क्योंकि इसकी ऊर्जा सबसे कम होती है। इसके बाद 2s में भरते हैं परमाणु कक्षक में s, p, d तथा f उपकोश होते हैं जिनमें अधिकतम इलेक्ट्रॉन क्रमशः 2, 6, 10 तथा 14 रह सकते हैं।
Note –
ऑफबाऊ नियम द्वारा तत्वों के इलेक्ट्रॉनिक विन्यास बनाने के लिए विभिन्न परमाणु उपकोशों की अपेक्षिक ऊर्जाओं का ज्ञान आवश्यक है।
| तत्व | परमाणु क्रमांक | इलेक्ट्रॉनिक विन्यास |
| H | 1 | 1s1 |
| He | 2 | 1s2 |
| Li | 3 | 1s2 2s1 |
| Be | 4 | 1s2 2s2 |
| B | 5 | 1s2 2s2 2p1 |
| C | 6 | 1s2 2s2 2p2 |
| N | 7 | 1s2 2s2 2p3 |
| O | 8 | 1s2 2s2 2p4 |
| F | 9 | 1s2 2s2 2p5 |
| Ne | 10 | 1s2 2s2 2p6 |
| Na | 11 | 1s2 2s2 2p6 3s1 |
| Mg | 12 | 1s2 2s2 2p6 3s2 |
| Al | 13 | 1s2 2s3 2p6 3s2 3p1 |
| Si | 14 | 1s2 2s3 2p6 3s2 3p2 |
| P | 15 | 1s2 2s3 2p6 3s2 3p3 |
अतः इस प्रकार ऑफबाऊ नियम के द्वारा तत्वों के इलेक्ट्रॉनिक विन्यास ज्ञात किए जाते हैं। यहां हमने केवल 15 तत्वों के इलेक्ट्रॉनिक विन्यास ही निकाले हैं। ऐसे ही आप आगे के सभी तत्व ज्ञात कर सकते हैं।

Leave a Reply