Important Questions For All Chapters – राजनीति विज्ञान Class 12
उपसहसंयोजन यौगिक
प्रश्न 1. निम्नलिखित संकुलों को उनके विलयन की चालकता के बढ़ते क्रम में व्यवस्थित करें:
उत्तर:
आयनीकरणीय आयन या अणु समन्वय क्षेत्र के बाहर मौजूद होते हैं। जब कोई कॉम्प्लेक्स घुलता है, तो वह ज़्यादा आयन छोड़ता है, जिससे वह ज़्यादा सुचालक बन जाता है।
यहां, आयनों की संख्या बढ़ जाती है और चालकता बढ़ जाती है।
Q2. एक समन्वय यौगिक CrCl, \(4H_2\) O सिल्वर नाइट्रेट के साथ उपचारित करने पर सिल्वर क्लोराइड अवक्षेपित करता है। इसके विलयन की मोलर चालकता कुल दो आयनों के अनुरूप है। यौगिक का संरचनात्मक सूत्र लिखें और उसका नाम बताएँ।
उत्तर:
कॉम्प्लेक्स के बाहर क्लोराइड आयन होता है क्योंकि सिल्वर नाइट्रेट के साथ उपचार करने पर सिल्वर क्लोराइड अवक्षेपित हो जाता है। कॉम्प्लेक्स के बाहर केवल एक क्लोराइड आयन होता है क्योंकि केवल दो आयन उत्पन्न होते हैं। परिणामस्वरूप, यौगिक का संरचनात्मक सूत्र और नामकरण इस प्रकार है:
\([Co(H_2 O)_4 Cl_2 ]Cl\) = टेट्राएक्वाडाइक्लोरीडोकोबाल्ट(III) क्लोराइड।
प्रश्न 3. [ MnCl4\(]^{2-}\) का चुंबकीय आघूर्ण 5.92 BM है। समझाइए क्यों
उत्तर:
\(Mn^{2+}\) आयन के d-ऑर्बिटल्स में पाँच अयुग्मित इलेक्ट्रॉनों का अस्तित्व 5.92 BM के चुंबकीय आघूर्ण के अनुरूप है। परिणामस्वरूप, \(dsp^{2}\) के बजाय , \(sp^{3}\) संकरण का उपयोग किया जाता है। परिणामस्वरूप, \([MnCl_4]^{2-}\) कॉम्प्लेक्स की टेट्राहेड्रल संरचना में 5.92 BM का चुंबकीय आघूर्ण होगा।
स्पष्टीकरण:
क्योंकि समन्वय गोले पर कुल आवेश -2 है और संकुल में चार Cl लिगैंडों का आवेश -4 है, इसलिए केंद्रीय धातु परमाणु Mn की ऑक्सीकरण संख्या +2 होगी।
Mn ion पर अब +2 आवेश है, जिसका अर्थ है कि इसका उपयोग केवल एक बार ही किया जा सकता है।
ये पांचों इलेक्ट्रॉन अयुग्मित होंगे।
वर्तमान में, चुंबकीय आघूर्ण = √n(n+2)
जहाँ n अयुग्मित इलेक्ट्रॉनों की संख्या है।
इस स्थिति में n=5.
इसलिए,
= √ 5(5+2)
= √ 35
= 5.916
चुम्बकीय आघूर्ण = 5.92 BM.
प्रश्न 4. कम स्पिन टेट्राहेड्रल कॉम्प्लेक्स क्यों नहीं बनते हैं?
उत्तर:
टेट्राहेड्रल कॉम्प्लेक्स में, d-ऑर्बिटल ऑक्टाहेड्रल की तुलना में बहुत छोटा विभाजित होता है। समान धातु और समान लिगैंड के लिए Δt = 4/9Δ o ।
इसलिए, कक्षीय ऊर्जा युग्मन को बाध्य करने के लिए पर्याप्त नहीं है। परिणामस्वरूप, टेट्राहेड्रल परिसरों में कम स्पिन विन्यास शायद ही कभी देखा जाता है।
प्रश्न 5. क्रिस्टल क्षेत्र विभाजन सिद्धांत के आधार पर निम्नलिखित संकुलों का इलेक्ट्रॉनिक विन्यास दीजिए।
प्रश्न 6: किसी ऑक्टाहेड्रल समन्वय यौगिक में चुम्बकीय गुण और समरूपता का वर्णन करें। उदाहरण के साथ समझाएँ।
उत्तर:
ऑक्टाहेड्रल समन्वय यौगिक में चुम्बकीय गुण और समरूपता निम्नलिखित कारकों पर निर्भर करते हैं:
d-कक्षीयों में इलेक्ट्रॉनों का वितरण: ऑक्टाहेड्रल समन्वय यौगिकों में, d-कक्षीयों का विभाजन t2g और eg समूहों में होता है। यदि विभाजन ऊर्जा (Δo) अधिक होती है, तो इलेक्ट्रॉन t2g कक्षीयों में युग्मित हो जाते हैं। यदि Δo कम होती है, तो इलेक्ट्रॉन eg कक्षीयों में बिना युग्मित हुए रहते हैं।
उच्च-गति और निम्न-गति परिसरों: जब Δo > P (युग्मन ऊर्जा), तो इलेक्ट्रॉन t2g कक्षीयों में युग्मित हो जाते हैं, और यौगिक निम्न-गति (low-spin) बनता है। जब Δo < P, तो यौगिक उच्च-गति (high-spin) बनता है, जिसमें अधिक असंपरीक्षित इलेक्ट्रॉन होते हैं।
चुम्बकीय गुण: उच्च-गति परिसरों में अधिक असंपरीक्षित इलेक्ट्रॉन होते हैं, इसलिए वे पैरामेग्नेटिक होते हैं। निम्न-गति परिसरों में कम या कोई असंपरीक्षित इलेक्ट्रॉन नहीं होते, इसलिए वे डायमेग्नेटिक होते हैं।
उदाहरण:
\([Fe(CN)_6]^{3-}\) और \([FeF_6]^{3-}\) दोनों ऑक्टाहेड्रल समन्वय यौगिक हैं। \([Fe(CN)_6]^{3-}\) में CN⁻ एक मजबूत फील्ड लिगेंड है, इसलिए यह निम्न-गति परिसर होता है और इसमें केवल एक असंपरीक्षित इलेक्ट्रॉन होता है, जिससे यह कमजोर पैरामेग्नेटिक होता है। वहीं, \([FeF_6]^{3-}\) में F⁻ एक कमजोर फील्ड लिगेंड है, इसलिए यह उच्च-गति परिसर होता है और इसमें पाँच असंपरीक्षित इलेक्ट्रॉन होते हैं, जिससे यह मजबूत पैरामेग्नेटिक होता है।
प्रश्न 7: वैलेंस बांड थ्योरी (Valence Bond Theory) के अनुसार समन्वय यौगिकों में बंध निर्माण की व्याख्या करें।
\([Ni(CN)_4]^{2-}\) और \([NiCl_4]^{2-}\) का उदाहरण देकर समझाएं।
उत्तर:
वैलेंस बांड थ्योरी (VBT) के अनुसार, समन्वय यौगिकों में धातु आयन लिगेंड्स के इलेक्ट्रॉन जोड़े को स्वीकार करते हैं और अपनी कक्षीयों का संकरण (hybridization) करके समन्वय बंध बनाते हैं। इस सिद्धांत के मुख्य बिंदु निम्नलिखित हैं:
कक्षीय संकरण (Hybridization): VBT के अनुसार, धातु आयन की खाली कक्षीयों का संकरण होता है, जिससे समन्वय यौगिकों में विभिन्न ज्यामितीय संरचनाएँ प्राप्त होती हैं। उदाहरण के लिए, ऑक्टाहेड्रल संरचना में \(d^2sp^3\) संकरण होता है जबकि टेट्राहेड्रल संरचना में \(sp^3\) संकरण होता है।
कक्षीय में इलेक्ट्रॉनों का समायोजन: लिगेंड के इलेक्ट्रॉन जोड़े धातु आयन की संकरण कक्षीयों में समायोजित होते हैं। यदि सभी इलेक्ट्रॉन युग्मित होते हैं, तो यौगिक डायमेग्नेटिक होता है। यदि असंपरीक्षित इलेक्ट्रॉन होते हैं, तो यौगिक पैरामेग्नेटिक होता है।
उदाहरण:
(1) \([Ni(CN)_4]^{2-}\)
इसमें निकेल आयन \(Ni^{2+}\) के रूप में होता है जिसका इलेक्ट्रॉनिक विन्यास \(3d^{8}\) होता है।
CN⁻ एक मजबूत फील्ड लिगेंड है, जो \(d^2sp^3\) संकरण का कारण बनता है, जिससे यह एक स्क्वायर प्लानर (square planar) संरचना बनाता है।
सभी इलेक्ट्रॉन युग्मित होते हैं, इसलिए यह यौगिक डायमेग्नेटिक होता है।
(2) \([NiCl_4]^{2-}\)
इसमें भी निकेल आयन \(Ni^{2+}\) के रूप में होता है जिसका इलेक्ट्रॉनिक विन्यास \(3d^{8}\) होता है।
Cl⁻ एक कमजोर फील्ड लिगेंड है, जो \(sp^3\) करण का कारण बनता है, जिससे यह एक टेट्राहेड्रल संरचना बनाता है।
इसमें दो असंपरीक्षित इलेक्ट्रॉन होते हैं, इसलिए यह यौगिक पैरामेग्नेटिक होता है।
इस प्रकार, VBT के अनुसार \([Ni(CN)_4]^{2-}\) एक डायमेग्नेटिक स्क्वायर प्लानर यौगिक है जबकि \([NiCl_4]^{2-}\) एक पैरामेग्नेटिक टेट्राहेड्रल यौगिक है।
प्रश्न 8: समन्वय यौगिकों के जैविक महत्व और औद्योगिक अनुप्रयोगों की व्याख्या करें।
उत्तर:
समन्वय यौगिकों का जैविक और औद्योगिक क्षेत्रों में अत्यधिक महत्व है। निम्नलिखित बिंदुओं में इसके महत्व को समझाया गया है:
(1.) जैविक महत्व:
क्लोरोफिल:
पौधों में प्रकाश संश्लेषण के लिए उत्तरदायी हरा रंगद्रव्य, क्लोरोफिल, एक मैग्नीशियम का समन्वय यौगिक है।
हीमोग्लोबिन:
रक्त में ऑक्सीजन परिवहन के लिए जिम्मेदार लाल रंगद्रव्य, हीमोग्लोबिन, एक आयरन का समन्वय यौगिक है।
विटामिन B12:
साइनोकॉबलमिन, जो कि विटामिन B12 है, एक कोबाल्ट का समन्वय यौगिक है और यह रक्त में लाल रक्त कोशिकाओं के निर्माण के लिए महत्वपूर्ण है।
(2.) औद्योगिक अनुप्रयोग:
विल्किन्सन उत्प्रेरक:
विल्किन्सन का उत्प्रेरक \([(Ph_3P)_3RhCl]\) का उपयोग एल्कीन के हाइड्रोजनीकरण के लिए किया जाता है।
धातु शोधन:
समन्वय यौगिकों का उपयोग धातुओं के शोधन में किया जाता है। उदाहरण के लिए, अशुद्ध निकेल को \([Ni(CO)_4]\) में परिवर्तित किया जाता है और फिर इसे शुद्ध निकेल प्राप्त करने के लिए विघटित किया जाता है।
चांदी और सोने की इलेक्ट्रोप्लेटिंग:
समन्वय यौगिकों \([Ag(CN)_2]^-\) और \([Au(CN)_2]^-\) का उपयोग इलेक्ट्रोप्लेटिंग में किया जाता है ताकि वस्तुओं पर चांदी और सोने की चिकनी परत चढ़ाई जा सके।
(3) औषधीय अनुप्रयोग:
कैंसर उपचार:
प्लेटिनम के समन्वय यौगिक जैसे ‘सिसप्लाटिन’ का उपयोग कैंसर के उपचार में किया जाता है क्योंकि ये यौगिक ट्यूमर के विकास को रोकने में सक्षम होते हैं।
धातु विषाक्तता का उपचार:
EDTA का उपयोग सीसा विषाक्तता के उपचार में किया जाता है, क्योंकि यह सीसे के साथ समन्वय यौगिक बनाकर उसे शरीर से बाहर निकाल देता है।

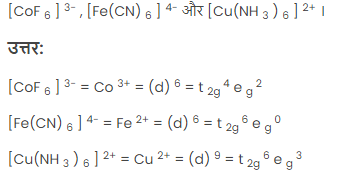
Leave a Reply