Important Questions For All Chapters – रसायन विज्ञान Class 11
साम्यावस्था
प्रश्न 1: रासायनिक और भौतिक प्रक्रियाओं में संतुलन की गतिशीलता की प्रकृति का वर्णन करें।
उत्तर:
रासायनिक और भौतिक संतुलन दोनों ही गतिशील होते हैं, जिसका अर्थ है कि यद्यपि प्रणाली संतुलन की स्थिति में होती है, फिर भी प्रतिक्रियाएं आगे और पीछे दोनों दिशाओं में होती रहती हैं। उदाहरण के लिए, जब पानी एक बंद बर्तन में वाष्पीकृत होता है, तो वाष्प की मात्रा बढ़ती है और फिर धीरे-धीरे एक संतुलन स्थिति में पहुंच जाती है जहां पानी वाष्प और तरल अवस्था में संतुलन में होता है। इसी प्रकार, रासायनिक संतुलन में, प्रतिक्रियाएं आगे और पीछे दोनों दिशाओं में समान गति से होती हैं, जिससे प्रतिक्रिया के उत्पादों और अभिकारकों की सांद्रता स्थिर रहती है। इस स्थिति को गतिशील संतुलन कहते हैं क्योंकि प्रतिक्रिया सतत रूप से घटित होती रहती है, भले ही कुल सांद्रता में कोई बदलाव न हो।
प्रश्न 2: रासायनिक संतुलन के लिए समतुल्यता स्थिरांक \(K_c\) की परिभाषा दें और इसका महत्व समझाएं।
उत्तर:
रासायनिक संतुलन में समतुल्यता स्थिरांक \(K_c\) उस अनुपात को दर्शाता है, जिसमें उत्पादों की सांद्रता को उनके क्रमागत घातांक से गुणा कर विभाजित किया जाता है और अभिकारकों की सांद्रता को उनके क्रमागत घातांक से गुणा कर लिया जाता है। यह संतुलन की स्थिति में सांद्रता का स्थिर अनुपात है और इसे निम्नलिखित प्रकार से लिखा जा सकता है:
यहाँ, aA + bB ↔ cC + dD एक सामान्य प्रतिक्रिया है। \(K_c\) का महत्व इस बात में है कि यह हमें बताता है कि प्रतिक्रिया किस हद तक आगे बढ़ी है। यदि \(K_c\) का मान बड़ा है, तो प्रतिक्रिया अधिकतर उत्पाद की दिशा में जाती है, और यदि यह छोटा है, तो प्रतिक्रिया मुख्य रूप से अभिकारकों की दिशा में होती है। इस प्रकार, \(K_c\) के मान का उपयोग करके हम यह अनुमान लगा सकते हैं कि किसी विशेष प्रतिक्रिया में उत्पाद और अभिकारक किस अनुपात में मौजूद होंगे।
प्रश्न 3: ले शेटेलियर का सिद्धांत (Le Chatelier’s Principle) क्या है, और यह कैसे सांद्रता, दाब और तापमान में परिवर्तन पर प्रतिक्रिया की दिशा को प्रभावित करता है?
उत्तर:
ले शेटेलियर का सिद्धांत कहता है कि यदि किसी संतुलन अवस्था में किसी बाहरी कारक (जैसे सांद्रता, दाब, या तापमान) में परिवर्तन किया जाता है, तो प्रतिक्रिया उस दिशा में शिफ्ट होती है जिससे उस परिवर्तन का प्रभाव कम हो जाए। उदाहरण के लिए:
सांद्रता में परिवर्तन: यदि अभिकारकों या उत्पादों की सांद्रता बढ़ाई जाती है, तो प्रतिक्रिया उस दिशा में शिफ्ट होगी जिससे अतिरिक्त सांद्रता को खपत किया जा सके।
दाब में परिवर्तन: यदि किसी गैसीय प्रतिक्रिया में दाब बढ़ाया जाता है, तो प्रतिक्रिया उस दिशा में शिफ्ट होगी जहाँ कम गैस अणु होते हैं, जिससे दाब कम किया जा सके।
तापमान में परिवर्तन: यदि प्रतिक्रिया उष्माक्षेपी (exothermic) है और तापमान बढ़ाया जाता है, तो प्रतिक्रिया वाम दिशा में शिफ्ट होगी, जिससे अतिरिक्त तापमान को खपत किया जा सके।
ले शेटेलियर के सिद्धांत का मुख्य उपयोग औद्योगिक प्रक्रियाओं में प्रतिक्रिया की उत्पादकता बढ़ाने के लिए किया जाता है, जैसे अमोनिया संश्लेषण में।
प्रश्न 4: रासायनिक संतुलन में \(K_c\) और \(K_p\) के बीच का संबंध स्पष्ट करें और उदाहरण देकर समझाएं।
उत्तर:
\(K_c\) और \(K_p\) रासायनिक संतुलन के लिए दो महत्वपूर्ण स्थिरांक हैं, जहाँ \(K_c\) अभिकारकों और उत्पादों की सांद्रता पर आधारित है, और \(K_p\) उनकी आंशिक दाबों पर आधारित है। \(K_c\) और \(K_p\) के बीच का संबंध इस प्रकार है:
प्रश्न 5: रासायनिक संतुलन की अवस्था तक पहुँचने के लिए आवश्यक शर्तों का वर्णन करें।
उत्तर:
रासायनिक संतुलन की अवस्था वह स्थिति होती है जब किसी रासायनिक प्रतिक्रिया में अभिकारकों और उत्पादों की सांद्रता समय के साथ स्थिर हो जाती है और आगे और पीछे दोनों दिशाओं में प्रतिक्रियाएँ समान गति से होती रहती हैं। इस स्थिति तक पहुँचने के लिए निम्नलिखित शर्तों का पूरा होना आवश्यक है:
बंद प्रणाली (Closed System): रासायनिक संतुलन केवल एक बंद प्रणाली में ही प्राप्त किया जा सकता है, जहाँ न तो कोई पदार्थ बाहर जा सकता है और न ही कोई नया पदार्थ अंदर आ सकता है।
तापमान स्थिर होना चाहिए: संतुलन की स्थिति में पहुँचने के लिए तापमान स्थिर होना चाहिए। तापमान में परिवर्तन से प्रतिक्रिया की गति और संतुलन की दिशा प्रभावित होती है।
आरंभिक सांद्रता: अभिकारकों और उत्पादों की प्रारंभिक सांद्रता भी संतुलन की अवस्था को प्रभावित करती है। समय के साथ, सांद्रता बदलती रहती है और एक समय के बाद स्थिर हो जाती है, जिससे संतुलन प्राप्त होता है।
रासायनिक प्रतिक्रिया की दिशा: संतुलन की अवस्था दोनों दिशाओं में हो सकती है – आगे की दिशा (अभिकारकों से उत्पादों की ओर) और पीछे की दिशा (उत्पादों से अभिकारकों की ओर)। संतुलन की अवस्था में, दोनों दिशाओं में प्रतिक्रिया की गति समान होती है।
प्रश्न 6: हेबर प्रक्रिया में संतुलन की स्थिति को प्रभावित करने वाले कारकों का वर्णन करें और उनकी औद्योगिक महत्व पर चर्चा करें।
उत्तर:
हेबर प्रक्रिया (Haber Process) में नाइट्रोजन और हाइड्रोजन से अमोनिया (NH3) का उत्पादन किया जाता है। यह प्रक्रिया संतुलन की स्थिति को प्रभावित करने वाले विभिन्न कारकों पर निर्भर करती है, जो इस प्रकार हैं:
दाब (Pressure): उच्च दाब पर, प्रतिक्रिया दाहिनी ओर (अमोनिया के उत्पादन की दिशा) शिफ्ट होती है। इसलिए, औद्योगिक स्तर पर अमोनिया उत्पादन के लिए उच्च दाब का उपयोग किया जाता है।
तापमान (Temperature): यह एक उष्माक्षेपी प्रतिक्रिया है, इसलिए निम्न तापमान पर प्रतिक्रिया दाहिनी ओर शिफ्ट होती है, लेकिन बहुत कम तापमान पर प्रतिक्रिया की गति धीमी हो जाती है। इसलिए, एक मध्यम तापमान (लगभग 450-500°C) का चयन किया जाता है ताकि संतुलन और प्रतिक्रिया की गति दोनों में सामंजस्य स्थापित हो सके।
उत्पाद की निरंतर निकासी: अमोनिया को प्रतिक्रिया मिश्रण से लगातार हटाया जाता है, जिससे प्रतिक्रिया संतुलन की स्थिति से आगे बढ़ती रहती है और अधिक अमोनिया का उत्पादन होता है।
उत्प्रेरक (Catalyst): लोहे का उत्प्रेरक (Fe) इस प्रक्रिया में उपयोग किया जाता है जो प्रतिक्रिया की गति को बढ़ाता है और संतुलन जल्दी प्राप्त करने में मदद करता है।
औद्योगिक महत्व: हेबर प्रक्रिया औद्योगिक दृष्टि से अत्यंत महत्वपूर्ण है क्योंकि अमोनिया का उपयोग उर्वरकों, विस्फोटकों और अन्य रसायनों के उत्पादन में किया जाता है। इस प्रक्रिया में संतुलन की स्थिति को प्रभावित करने वाले कारकों का कुशलता से उपयोग करके अमोनिया का अधिकतम उत्पादन संभव है, जो कि कृषि और रासायनिक उद्योग के लिए महत्वपूर्ण है।
प्रश्न 7: धातुओं के शुद्धिकरण में संतुलन की अवधारणा का प्रयोग कैसे किया जाता है? एक उदाहरण दें।
उत्तर:
धातुओं के शुद्धिकरण में संतुलन की अवधारणा का प्रयोग धातु की अशुद्धियों को दूर करने और उसे शुद्ध अवस्था में प्राप्त करने के लिए किया जाता है। संतुलन का प्रयोग धातु के कार्बोनाइल (Carbonyl) यौगिकों के निर्माण में किया जाता है, जहाँ धातु और कार्बन मोनोऑक्साइड (CO) एक विशेष तापमान और दाब पर संतुलन स्थिति में पहुँचते हैं।
उदाहरण: निकेल के शुद्धिकरण में यह प्रक्रिया महत्वपूर्ण भूमिका निभाती है। जब अशुद्ध निकेल (Ni) को कार्बन मोनोऑक्साइड गैस के साथ 330-350K तापमान पर प्रतिक्रिया कराई जाती है, तो निकेल कार्बोनाइल (Ni(CO)₄) का निर्माण होता है:
\(Ni(s) + 4CO(g) ↔ Ni(CO)_4(g)\)
यह प्रतिक्रिया संतुलन पर आधारित होती है, जहाँ अधिक दाब पर निकेल कार्बोनाइल का उत्पादन होता है। इसके बाद, निकेल कार्बोनाइल को 450-470K तापमान पर गर्म किया जाता है, जहाँ यह टूटकर शुद्ध निकेल और कार्बन मोनोऑक्साइड में परिवर्तित हो जाता है:
\(Ni(CO)_4(g) → Ni(s) + 4CO(g)\)
इस प्रकार संतुलन की अवधारणा का उपयोग करके धातु को शुद्ध किया जाता है, जो धातु उद्योग में अत्यधिक महत्वपूर्ण है।
प्रश्न 8: समतुल्यता अभिव्यक्ति में ठोस और द्रवों का सम्मिलन कैसे किया जाता है? एक उदाहरण के साथ समझाएं।
उत्तर:
समतुल्यता अभिव्यक्ति में ठोस और द्रवों का सम्मिलन किया जाता है, लेकिन उनकी सांद्रता को स्थिर माना जाता है। ठोस और शुद्ध द्रवों की सांद्रता को समतुल्यता अभिव्यक्ति में नहीं जोड़ा जाता क्योंकि उनकी सांद्रता प्रतिक्रिया के दौरान नहीं बदलती।
उदाहरण: कैल्शियम कार्बोनेट के विघटन की प्रतिक्रिया को लें:
\(CaCO_3(s) ↔ CaO(s) + CO_2(g)\)
इसमें केवल \(CO_2\) गैस की सांद्रता को ही समतुल्यता अभिव्यक्ति में लिया जाएगा, क्योंकि \(CaCO_3\) और CaO ठोस अवस्था में हैं और उनकी सांद्रता स्थिर रहती है:
लेकिन, \(CaCO_3\) और CaO की सांद्रता स्थिर होती है, इसलिए इसे साधारणतः \(K_c = [CO_2]\) के रूप में लिखा जाता है। इस प्रकार, ठोस और शुद्ध द्रवों को समतुल्यता अभिव्यक्ति में नहीं गिना जाता, क्योंकि उनका योगदान स्थिर होता है।
प्रश्न 9:जलीय विलयों में आयनिक संतुलन की अवधारणा को समझाएं और इसका महत्व बताएं।
उत्तर:
जलीय विलयों में आयनिक संतुलन तब स्थापित होता है जब आयनों का गठन और उनका विघटन समान गति से होता है, जिससे आयनों की सांद्रता समय के साथ स्थिर हो जाती है। इसका अर्थ यह है कि जलीय विलयों में उपस्थित इलेक्ट्रोलाइट्स आंशिक रूप से आयनित होते हैं और आयनों की उपस्थिति एक गतिशील संतुलन की स्थिति में रहती है।
उदाहरण: सिरका अम्ल (Acetic Acid) का जलीय विलयन:
\(CH_3COOH ↔ CH_3COO^- + H^+\)
इस संतुलन में सिरका अम्ल आंशिक रूप से आयनित होता है और जलीय विलयन में \(CH_3COO^-\) और \(H^+\) आयनों की स्थिर सांद्रता प्राप्त होती है। इसका महत्व इस बात में है कि जलीय विलयों में आयनिक संतुलन का प्रयोग कई रासायनिक प्रतिक्रियाओं, जैविक प्रक्रियाओं और औद्योगिक प्रक्रियाओं में किया जाता है, जैसे बफर विलयन की तैयारी, अम्ल-क्षार संतुलन, और विद्युत अपघटन (Electrolysis) में।
प्रश्न 10:आयनिक उत्पाद (Ionic Product) और इसका जल के आयनीकरण में क्या महत्व है, इसे स्पष्ट करें।
उत्तर:
आयनिक उत्पाद (Ionic Product) किसी जलीय विलयन में उपस्थित हाइड्रोजन आयन (\(H^+\)) और हाइड्रॉक्साइड आयन \((OH^-)\) की सांद्रताओं का गुणनफल होता है। जल के लिए आयनिक उत्पाद \(K_w\) कहलाता है और इसे निम्नलिखित रूप में लिखा जाता है:
\(K_w = [H^+][OH^-]\)
शुद्ध जल में \([H^+][OH^-]\) होता है, और \(K_w\) का मान 298 K (25°C) पर \(1.0 × 10^{-14}\) होता है। यह संतुलन स्थिरांक जल के आयनीकरण की प्रक्रिया का एक महत्वपूर्ण मापदंड है, क्योंकि यह बताता है कि जल में कितने \(H^+\) और \(OH^-\) आयन स्वाभाविक रूप से उपस्थित होते हैं।
महत्व:
pH मापन: \(K_w\) का उपयोग pH मापने के लिए किया जाता है, जो कि किसी विलयन की अम्लीयता या क्षारीयता को मापता है। \(pH = − log[H^+]\) के द्वारा \(H^+\) आयनों की सांद्रता से pH की गणना की जा सकती है।
तटस्थता: शुद्ध जल में \([H^+]\) और \([OH^-]\) दोनों की सांद्रता \(10^{-7}M\) होती है, जिससे pH = 7 प्राप्त होता है, जो तटस्थता का सूचक है। यदि \([H^+] > [OH^-]\) हो, तो विलयन अम्लीय होगा और यदि \([OH^-] > [H^+]\)हो, तो विलयन क्षारीय होगा।
अम्ल-क्षार संतुलन: \(K_w\) का उपयोग विभिन्न अम्ल-क्षार संतुलनों के अध्ययन में किया जाता है। जैसे किसी अम्ल को जल में घोलने पर \([H^+]\) बढ़ता है और
\([OH^-]\) घटता है, जिससे pH कम हो जाता है।
प्रश्न 11: बफर विलयन (Buffer Solution) क्या है और इसका कार्य कैसे होता है? एक उदाहरण देकर समझाएं।
उत्तर:
बफर विलयन (Buffer Solution) एक ऐसा जलीय विलयन होता है जो उसमें थोड़ी मात्रा में अम्ल या क्षार जोड़ने पर भी अपने pH को लगभग स्थिर बनाए रखता है। बफर विलयन आमतौर पर एक कमजोर अम्ल और उसके संगत लवण या एक कमजोर क्षार और उसके संगत लवण का मिश्रण होता है।
कार्य प्रणाली: बफर विलयन का कार्य इस पर निर्भर करता है कि इसमें उपस्थित घटक किस प्रकार के हैं:
अम्लीय बफर: इसमें एक कमजोर अम्ल और उसका संगत लवण होता है। उदाहरण के लिए, एसीटिक एसिड \((CH_3COOH)\) और सोडियम एसीटेट \((CH_3COONa)\) का मिश्रण। जब इसमें हाइड्रोजन आयन \((H^+)\) जोड़ा जाता है, तो यह \(CH_3COO^-\) आयन से प्रतिक्रिया करता है और \(CH_3COOH\) बनाता है, जिससे \(H^+\) आयन का प्रभाव निष्प्रभावी हो जाता है और pH में परिवर्तन नहीं होता।
क्षारीय बफर: इसमें एक कमजोर क्षार और उसका संगत लवण होता है। उदाहरण के लिए, अमोनियम हाइड्रोक्साइड \((NH_4OH)\) और अमोनियम क्लोराइड \((NH_4Cl)\) का मिश्रण। जब इसमें हाइड्रॉक्साइड आयन \((OH^-)\) जोड़ा जाता है, तो यह \(NH^+_4\) आयन से प्रतिक्रिया करता है और \(NH_4OH\) बनाता है, जिससे \(OH^-\) आयन का प्रभाव निष्प्रभावी हो जाता है और pH स्थिर रहता है।
उदाहरण: बफर विलयन का एक उदाहरण रक्त है। रक्त एक प्राकृतिक बफर है, जो शरीर में pH को लगभग 7.4 पर बनाए रखता है। इसमें बाइकार्बोनेट आयन (\(HCO^-_3\)) और कार्बोनिक एसिड (\(H_2CO_3\)) का संतुलन होता है, जो शरीर में बनने वाले अम्ल और क्षार को तटस्थ करता है और pH में किसी भी बड़े बदलाव को रोकता है।
प्रश्न 12: सोल्युबिलिटी उत्पाद स्थिरांक (\(K_{sp}\)) क्या है और इसका महत्व क्या है?
उत्तर:
सोल्युबिलिटी उत्पाद स्थिरांक (\(K_{sp}\)) वह स्थिरांक है जो किसी कम घुलनशील यौगिक के संतृप्त विलयन में उपस्थित आयनों की सांद्रता के गुणनफल को दर्शाता है। इसे निम्नलिखित रूप में व्यक्त किया जाता है:
\(K_{sp} = [A^m]^a × [B^n]^b\)जहाँ, \(A^m B^n\) एक कम घुलनशील यौगिक है जो \(aA^m\)और \(bB^n\) आयनों में विघटित होता है।
महत्व:
विलेयता निर्धारण: \(K_{sp}\) के मान से किसी यौगिक की विलेयता (Solubility) का निर्धारण किया जा सकता है। यदि \(K_{sp}\) का मान अधिक है, तो यौगिक की विलेयता अधिक होगी, और यदि \(K_{sp}\) का मान कम है, तो यौगिक की विलेयता कम होगी।
धनायन और ऋणायन की सांद्रता का प्रभाव: यदि विलयन में पहले से ही किसी आयन की सांद्रता अधिक है, तो यह संतुलन को उत्पादों की दिशा में शिफ्ट करेगा, जिससे यौगिक की विलेयता घट जाएगी। इसे सामान्य आयन प्रभाव (Common Ion Effect) कहते हैं।
अवक्षेपण (Precipitation) की भविष्यवाणी: \(K_{sp}\) का उपयोग यह भविष्यवाणी करने के लिए किया जा सकता है कि किसी विशेष यौगिक का अवक्षेपण होगा या नहीं। यदि विलयन में उपस्थित आयनों का गुणनफल \(K_{sp}\) से अधिक है, तो यौगिक का अवक्षेपण होगा। इस प्रकार, सोल्युबिलिटी उत्पाद स्थिरांक का अध्ययन रासायनिक संतुलन, विलेयता और अवक्षेपण प्रक्रियाओं को समझने में महत्वपूर्ण भूमिका निभाता है।

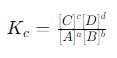

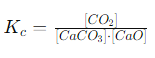
Leave a Reply